Zalety diagnostyki przedimplantacyjnej, czyli badania genetycznego zarodków, są powszechnie znane. Przede wszystkim, dzięki diagnostyce PGT-A, czyli weryfikacji dużych mutacji chromosomowych (tzw. aneuploidii) w zarodkach, możemy zmniejszyć ryzyko urodzenia dziecka chorego np. na Zespół Downa, Edwardsa, Patau, Turnera i Klinefeltera. Niekwestionowana jest rola diagnostyki PGT-M oraz PGT-SR, w przypadku, gdy pacjenci są nosicielami mutacji genetycznej – wówczas możliwe jest zbadanie zarodka i stwierdzenie, czy odziedziczył tę zmianę w genomie.
Korzyści jest jednak więcej, przede wszystkim krótszy czas do uzyskania ciąży i niższe ryzyko poronienia (nie podajemy zarodków obarczonych aneuploidią). Często słyszymy, że główną przyczyną, dla której zarodek się nie implantuje lub obumiera, jest właśnie przyczyna genetyczna, czyli nieprawidłowości w samym zarodku.
Nie wszystko jest jednak czarno-białe. Gdyby tak było, po podaniu wyłącznie zdrowych zarodków, uzyskalibyśmy stuprocentową skuteczność, a tak nie jest. Owszem, ogólnie rzecz biorąc, skuteczność po zastosowaniu PGT-A jest wyższa niż bez diagnostyki, jednak nigdy nie ma pewności, że uzyskamy ciążę. Dlaczego?
Po pierwsze, nie wszystko zależy od zarodka. Implantacja to złożony proces, w którym z jednej strony, bierze udział zarodek, a z drugiej endometrium macicy. Ponieważ to nie implantacja jest tematem tego artykułu, nie rozwijam dalej tej kwestii.
Po drugie, wady genetyczne mogą powstać jeszcze po tym, jak pobierzemy materiał do badania genetycznego z blastocysty. Zarodek to żywy organizm, który się rozwija i niestety w każdym momencie mogą wystąpić nieprawidłowe podziały i mutacje genetyczne… To tak, jak z dorosłymi – to, że dziś jesteśmy zdrowi, a wyniki badań są bardzo dobre, nie oznacza, że za miesiąc nie zachorujemy. Dla zarodka każdy dzień to szmat czasu – jest mały i składa się z dużo mniejszej ilości komórek, niż dorosły człowiek, zatem nawet niewielka mutacja może mieć dla niego poważne skutki.
Po trzecie i najważniejsze – sama diagnostyka przedimplantacyjna może ograniczyć szanse na uzyskanie ciąży. I nie chodzi mi tylko o biopsję trofektodermy, czyli inwazyjne pobranie materiału do badania (pisałam o tym w poprzednim artykule – Czy moje dziecko będzie zdrowe, czyli jak badamy zarodki? Część 2.). Chodzi mi o „nadużywanie” diagnostyki u par, u których nie ma wskazań do jej zastosowania. Ale po kolei…
Mozaicyzm – co to takiego?
Zacznę od wytłumaczenia pojęcia, które być może kiedyś usłyszeliście od lekarza prowadzącego, embriologa, lub po prostu sami na nie trafiliście w Internecie. Mozaicyzm to obecność komórek o różnym kariotypie w obrębie zarodka. Wyobraźmy sobie jabłko, które ma na swojej skórce małą, zepsutą plamkę. Niektórzy odcinają ten fragment i jedzą jabłko, a inni wyrzucają cały owoc do kosza twierdząc, że jeśli zaczął się proces gnicia, to nie należy go jeść. Co zrobić z zarodkiem, który ma kilka, czasem kilkanaście, a nawet kilkadziesiąt komórek, w których występuje nieprawidłowa liczba chromosomów? Załóżmy, że nie zdecydujemy się go transferować… Częstość mozaicyzmu szacuje się w różnych publikacjach bardzo różnie – od kilku do kilkudziesięciu procent. Aktualnie wśród biologów panuje przekonanie, że mozaicyzm może występować w niemal 100% zarodków. Nie możemy i nigdy nie będziemy mogli tego zweryfikować, bo musielibyśmy zniszczyć cały zarodek. Znając mechanizmy mitozy, czyli podziałów komórkowych w zarodku, możemy założyć, że istnieje ryzyko, że coś pójdzie nie tak, chociażby w jednej komórce, która podzieli się na dwie kolejne, a każda z nich na dwie następne… Mając świadomość, że prawie w każdym zarodku istnieją mutacje genetyczne (może tylko w kilku komórkach, ale jednak), zapewne musimy porządnie się zastanowić, czy nadal nie zdecydujemy się na transfer takiego mozaikowego zarodka.
Nie taki diabeł straszny
Czy powinniśmy się bać mozaicyzmu? Wszystko zależy od tego, jaką część zarodka zajmuje (czyli jaka część jabłka jest zepsuta). Zakłada się, że zarodki z niewielkim odsetkiem aneuploidalnych komórek (20-40%), mogą dać zdrową ciążę i powinno się je rozważyć do transferu, gdy nie ma zarodków euploidalnych (takich, w których nie stwierdzono wad chromosomowych). Jeśli zarodki w 40-80% składają się z nieprawidłowych komórek, nie powinno się ich transferować ze względu na wysokie ryzyko. Podobnie, jeśli nieprawidłowości dotyczą nie jednego, ale dwóch lub trzech chromosomów, także ich transfer byłby bardziej ryzykowny.
Drugim ważnym czynnikiem, poza stopniem mozaicyzmu w zarodku, jest także wiek kobiety. Niedawno uczestniczyłam w bardzo ciekawym wykładzie na temat mozaicyzmu. Do tej pory uważano, że mozaicyzm występuje z równą częstością u kobiet młodszych i starszych, jednak okazuje się, że u pań poniżej 35 roku życia częściej zdarzają się zarodki mozaikowe, a u starszych – rzadziej (oczywiście z wiekiem przeważa także odsetek zarodków aneuploidalnych). Gdyby mozaicyzm był zjawiskiem całkowicie niepożądanym i złym, to dlaczego występuje częściej u kobiet młodszych, o dużym potencjale rozrodczym? Być może mozaicyzm to po prostu naturalne zjawisko, które, choć jeszcze nie do końca poznane i sprawiające sporo problemów diagnostycznych, nie powinno budzić paniki?
PGT a wiek pacjentki
Pisząc dla Was ten artykuł „przekopałam” wiele publikacji. Trafiłam na kilka ciekawych tekstów w tym temacie profesora Santiago Munne, który zajmuje się właśnie diagnostyką przedimplantacyjną zarodków od strony naukowej. Jego badania, to prawdziwa skarbnica wiedzy 😊 W jednej z jego publikacji, porównano skuteczność procedur zapłodnienia in vitro z zastosowaniem diagnostyki zarodków oraz bez niej, w różnych grupach wiekowych kobiet. Okazuje się, że w grupie pacjentek młodych, poniżej 35 roku życia, skuteczność zapłodnienia in vitro (licząc 20 – tygodniowe ciąże kliniczne) nie zwiększa się w przypadku, jeśli stosujemy diagnostykę przedimplantacyjną, w porównaniu do próby kontrolnej bez diagnostyki. Dobre rezultaty uzyskujemy dzięki PGT u pacjentek starszych, powyżej 35 roku życia. W tej grupie po transferach zbadanych, tylko prawidłowych zarodków, mamy aż o 14% więcej ciąż klinicznych. Dane przedstawiłam Wam na wykresie poniżej.
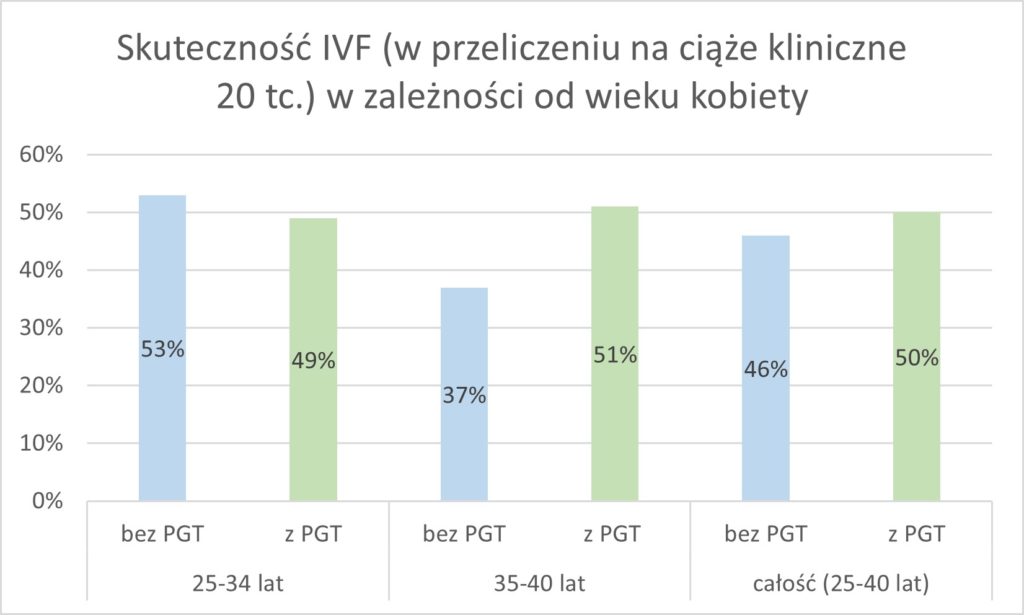
Podsumowując, jednym ze wskazań do zastosowania diagnostyki przedimplantacyjnej jest wiek pacjentki powyżej 35 roku życia. Jak widać – nie bez powodu. U młodszych pacjentek PGT nie poprawia szans w istotny statystycznie sposób. Nie należy więc „nadużywać” diagnostyki, bo nie zawsze jest to metoda zwiększająca powodzenie zabiegu. PGT na życzenie pacjentki to niezbyt dobry pomysł, dlatego diagnostykę wykonuje się, zgodnie z ustawą o leczeniu niepłodności, TYLKO jeśli istnieją wyraźne wskazania do jej zastosowania.
Co prawda w badaniu naukowym, które Wam przytaczam, zarodki mozaikowe nie były transferowane, jednak na chwilkę chciałabym powrócić do tematu mozaicyzmu i jego częstszego występowania u kobiet poniżej 35 roku życia: być może odrzucając zarodek z mozaicyzmem, zmniejszamy jeszcze bardziej szanse na ciążę u młodych kobiet? Wykazano, że mechanizmy samonaprawy zarodka działają sprawniej u kobiet przed 35 rokiem życia. Zarodek, w którym część komórek posiada aneuploidie, u kobiet młodych może zostać „naprawiony” z dużo większym prawdopodobieństwem, niż u kobiet po 35 roku życia. Diagnostyka przedimplantacyjna może w pewien sposób ograniczać szanse, z góry skazując zarodek na odrzucenie. Być może w naturze mechanizmy samonaprawy pozwoliłyby uzyskać zdrową ciążę? Jeśli zaciekawiłam Was tematem, zapraszam już do przeczytania kolejnego artykułu z serii, w którym opowiem o skuteczności transferów zarodków mozaikowych.
PGT a poronienia
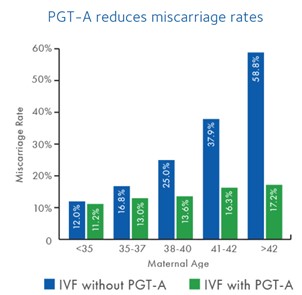
Wcześniejsze poronienia to jedno ze wskazań do diagnostyki PGT (także u pacjentek poniżej 35 roku życia). Oczywiście, jedną z głównych przyczyn poronień są właśnie wady genetyczne w zarodkach. Dlatego też diagnostyka przedimplantacyjna jest jedną z dostępnych metod, które mogą pomóc w znalezieniu przyczyny poronień. Mogą, ale nie muszą, ponieważ poronienia poniżej 35 roku życia niekoniecznie są spowodowane aneuploidiami w zarodkach. Jak wiemy, więcej wad genetycznych powstaje w zarodkach u kobiet starszych i to w tej grupie wiekowej zdecydowanie liczba poronień może zostać zredukowana dzięki diagnostyce przedimplantacyjnej. Spójrzcie na poniższy wykres (pochodzi ze strony PGT-A | Embryo Chromosomal Abnormalities Test | CooperSurgical Fertility | CooperSurgical Fertility Companies) U pacjentek poniżej 35 roku życia, PGT obniża odsetek poronień tylko o 0,8% (różnica nieistotna statystycznie). Widoczne różnice w odsetku poronień są zauważalne dopiero u kobiet po 35 roku życia. To kolejny argument za tym, że diagnostyka zarodków powinna być stosowana u młodych kobiet z dużą rozwagą!!!
Po tej dużej dawce wiedzy pochodzącej z badań naukowych, jeszcze krótki komentarz od #instaembriolożki 😉 Decyzja o zastosowaniu diagnostyki powinna być podjęta po dogłębnym przemyśleniu tematu, a nie ot tak, bo można. Nawet, jeśli dla kogoś koszty nie grają roli, trzeba pamiętać, że poza wymiernymi zyskami, można doświadczyć też straty. Życie to nie słupki, tabelki ani wykresy, a każdy wybór wiąże się z konsekwencjami dotyczącymi naszej przyszłości. Diagnostyka zarodków u kobiet starszych, jest niekwestionowanym, genialnym narzędziem, które skraca czas do uzyskania ciąży oraz zmniejsza ryzyko poronień i urodzenia chorego dziecka. PGT-A u kobiet młodszych może posłużyć diagnostyce genetycznej przyczyny niepowodzeń położniczych, jednak niekoniecznie rozwiąże wszystkie problemy i należy mieć to na uwadze. Oczywiście mówimy cały czas o diagnostyce aneuploidii (PGT-A), ponieważ diagnostykę celowaną (PGT-M, PGT-SR) należy stosować ZAWSZE, jeśli to możliwe, aby zniwelować ryzyko przekazania mutacji genetycznej na dziecko, bez względu na wiek pacjentki.
W kontekście tych wszystkich za i przeciw diagnostyce przedimplantacyjnej, zapraszam Was już na 4 część cyklu artykułów dotyczących PGT, w której opowiem, co to jest rebiopsja i co dzieje się z „chorymi” zarodkami, wrócę też do tematu mozaicyzmu w zarodkach.