PGT-A, czyli diagnostyka przedimplantacyjna umożliwia badanie genetyczne zarodka zanim zostanie on podany do macicy. Dzięki wykrywanym aneuploidiom (wadom chromosomowym), diagnostyka minimalizuje ryzyko urodzenia chorego dziecka oraz przyspiesza czas do uzyskania prawidłowej ciąży u kobiet starszych (po 35. roku życia). Istnieje jednak jeszcze inna metoda badania genetycznego zarodka, która nie wymaga biopsji trofektodermy (pobierania komórek z zarodka za pomocą igły). Jest to diagnostyka, która polega na badaniu cell-free DNA, czyli materiału genetycznego wydzielanego z komórek zarodka (do medium hodowlanego lub do jamy blastocysty).
Jak to działa?
Zarodek osiąga stadium wczesnej blastocysty zwykle ok. 4. – 5. dnia hodowli. W tym czasie ilość komórek w zarodku wciąż narasta, a każda komórka wydziela na zewnątrz cząsteczki materiału genetycznego. Im większa blastocysta, tym liczniejsze komórki i więcej cząsteczek DNA.
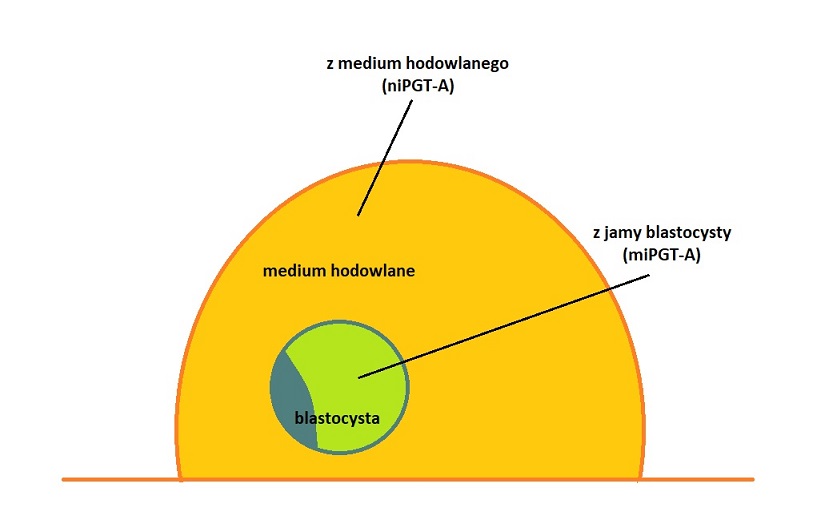
Idea diagnostyki nieinwazyjnej (niPGT-A) jest prosta – zarodek zamrażamy, a badamy medium, w którym zarodek się rozwijał. Minimalnie inwazyjną (miPGT-A) modyfikacją tego badania jest biopsja płynu z jamy blastocysty, która jest dużo mniej inwazyjna dla zarodka od biopsji komórek trofektodermy. Schematycznie miejsca pobierania materiału do badań niPGT-A i miPGT-A przedstawiam poniżej:

Zalety diagnostyki nieinwazyjnej:
– niższy koszt i łatwe pobranie materiału (w porównaniu z biopsją trofektodermy, niPGT-A nie wymaga specjalistycznego sprzętu ani przeszkolonego w tym zakresie embriologa, natomiast procedura miPGT-A jest o wiele łatwiejsza technicznie)
– bezpieczna dla zarodka (unikamy biopsji trofektodermy – to główna zaleta tego badania, ponieważ jest małoinwazyjna, a dla niektórych zarodków biopsja komórek może być poważna w skutkach)
Ograniczenia metody:
– głównym ograniczeniem jest pochodzenie cell-free DNA – nie zawsze pochodzi on z samego zarodka, często zdarza się zanieczyszczenie materiałem matczynym, materiałem z ciałka kierunkowego, komórek apoptotycznych i materiałem z zewnątrz (np. od embriologa). Przykładowo, według naukowców, zanieczyszczenie materiałem matczynym jest wykrywane w 86-94% próbek. Cząsteczki te utrudniają, a czasem także uniemożliwiają wiarygodną analizę. W celu zmniejszenia (ale nigdy nie całkowitego wyeliminowania) ryzyka kontaminacji niezbędne jest doświadczenie embriologów przeprowadzających hodowlę i ścisła kontrola jakości.
– niewielka ilość DNA – jeśli zarodek wydzielił zbyt mało cząsteczek DNA lub zaszła degradacja DNA, analiza nie będzie możliwa. Większa ilość cząsteczek jest uzyskiwana, gdy zarodki hodowane są dłużej – do 6. lub 7. dnia. Według jednej publikacji, odsetek cząsteczek DNA pochodzenia zarodkowego w badanych próbkach medium stanowił między 0% a 100%, co oznacza, że właściwie każda badana próbka może być inna (doi: 10.1093/humrep/dey028). Bardzo niewielką ilość DNA otrzymujemy również z płynu z jamy blastocysty w badaniu miPGT-A. Jest to zrozumiałe, bo jama blastocysty ma małą objętość. W jednym z badań tylko 34,8% próbek pobranych z jamy blastocysty nadawało się do badania genetycznego (doi: 10.1016/j.fertnstert.2018.05.031).
– wynik niediagnostyczny – ryzyko otrzymania takiego wyniku istnieje w przypadku każdego rodzaju diagnostyki np. z powodu degradacji próbki, zbyt małej ilości DNA, kontaminacji lub problemów na etapie amplifikacji DNA. W przypadku klasycznego inwazyjnego badania PGT-A zarodek jest rozmrażany, embriolog wykonuje powtórną biopsję trofektodermy i mrozi drugi raz zarodek. W metodzie nieinwazyjnej istnieją dwa rozwiązania: można rozmrozić zarodek i hodować go przez kilka kolejnych godzin, aby do medium znów wydzieliły się cząsteczki DNA (według publikacji niezbędnych jest minimum 8 godzin hodowli) lub zmienić metodę badawczą na inwazyjną biopsję trofektodermy.
Dlaczego diagnostyka nieinwazyjna nie zastąpiła jak dotąd inwazyjnego badania PGT-A?
Temat nie jest nowy, bo krążący w medium hodowlanym cell-free DNA odkryto w 2013 roku, a od 2016 pojawiają się publikacje porównujące skuteczność tej diagnostyki ze standardowym PGT-A. Czy badania inwazyjne i nieinwazyjne są zgodne (dają taki sam wynik)? Według publikacji, wyniki niPGT-A pokrywają się w ok. 80% z PGT-A. W największym jak dotąd badaniu (doi: 10.1016/j.ajog.2020.04.035) przeprowadzonym na podstawie 1301 blastocyst, wzięło udział 8 klinik. Uzyskano czułość między 76.5% a 91.3% i specyficzność między 64.7% a 93.3%. W innym badaniu (doi: 10.1007/s10815-019-01517-7) na podstawie 168 próbek mediów hodowlanych określono czułość na poziomie 81,6%, swoistość 48,3%, dodatnią wartość predykcyjną 82,6% i ujemną wartość predykcyjną 46,7%.
Objaśnienie pojęć /z pomocą Wikipedii/:
Czułość i swoistość – wartości opisujące zdolność testu do wykrycia badanej cechy (czułość) lub wykrycia jej braku (swoistość). Innymi słowy, zdolność badania do wykrycia wady genetycznej w zarodku (czułość) lub braku wad genetycznych w zarodku (swoistość).
Dodatnia wartość predykcyjna to prawdopodobieństwo, że zarodek z nieprawidłowym wynikiem faktycznie jest obarczony wadą genetyczną, a ujemna wartość predykcyjna to prawdopodobieństwo, że zarodek określony jako prawidłowy, faktycznie jest prawidłowy.
Naukowcy podkreślają, że wiarygodność diagnostyki nieinwazyjnej jest wysoka. Wyniki uzyskane dzięki PGT-A i niPGT-A wcale nie muszą i z pewnością nie będą pokrywać się w 100%. Badanie nieinwazyjne ocenia jakość materiału genetycznego całego zarodka, a nie tylko trofektodermy (warstwy zewnętrznej), co sugeruje, że może być nawet bardziej wiarygodne niż PGT-A.
Technika niPGT-A wymaga jednak wciąż większej ilości badań (zwykle publikacje dotyczące niPGT-A obejmują tylko kilkadziesiąt – kilkaset zarodków, jedna praca objęła 1301 zarodków). Publikacje pojawiają się coraz częściej (mniej więcej od 2019 roku), a temat jest niezwykle przyszłościowy. W jednej z prac naukowych z 2021 roku, uzyskano materiał do badania w 100% próbek z biopsji trofektodermy i tylko z 62,7% próbek mediów hodowlanych. Różnice w wynikach między tymi dwiema metodami uzyskano w 40,4% próbek. Z trzech zarodków, pomimo uzyskanego nieprawidłowego wyniku badania niPGT-A, uzyskano 3 zdrowe żywe urodzenia (na 22 transferowane zarodki) (doi: 10.1016/j.fertnstert.2021.01.028). W badaniu nieinwazyjnym krążący w medium materiał DNA może pochodzić np. z fragmentacji, czyli komórek lub ich fragmentów, które nie budują zarodka, ale zostały z niego wyrzucone. Te komórki zawierają bardzo często nieprawidłową ilość materiału genetycznego, co może zaburzać wynik badania i sugerować, że zarodek jest nieprawidłowy. Szczególnie u młodych pacjentek, możemy mieć tutaj do czynienia ze zjawiskiem „nadwykrywalności” zarodków nieprawidłowych, kiedy wynik świadczy o aneuploidii, a w rzeczywistości blastocysta jest prawidłowa genetycznie.
Diagnostyka miPGT-A na podstawie płynu z jamy blastocysty daje niższą wiarygodność: zgodność wyniku z badaniem na podstawie biopsji trofektodermy wynosi ok. 40%. Naukowcy tłumaczą to również nieznanym pochodzeniem cell-free DNA (z komórek zarodka, komórek apoptotycznych, degeneracji nieprawidłowych komórek w zarodku mozaikowym?).
Wciąż „złotym standardem” badania genetycznego zarodka jest diagnostyka inwazyjna PGT-A. Pomimo niewielkich kosztów i braku ryzyka dla zarodka, zastosowanie technik niPGT-A ma wiele ograniczeń i niedoskonałości.
Podsumowując:
– badanie niPGT-A wymaga ustandaryzowania
– badanie niPGT-A nie jest „takie samo” jak inwazyjna diagnostyka PGT-A, a pacjenci powinni zostać rzetelnie poinformowani o jego skuteczności
– jak czytamy na stronach promujących niPGT-A, badanie to „pozwala na wskazanie zarodków o najwyższym potencjale rozwojowym, implantacyjnym” i ustaleniu priorytetu do transferu. Dokładnie tak samo, jak ocena morfologiczna zarodków pomaga ustalić kolejność zarodków do transferu (najwyższy potencjał mają zarodki najlepszej klasy, z reguły podawane są jako pierwsze).
Komentarz ode mnie:
niPGT-A ma ogromny potencjał, jest badaniem innowacyjnym i każdy embriolog z zapartym tchem śledzi odkrycia naukowców w tym temacie. Dlaczego? Biopsja trofektodermy jest inwazyjna i nawet, jeśli większość zarodków przeżywa bez problemu, embriolog „nie lubi” narażać zarodka, ani poddawać go żadnym dodatkowym procedurom, które nie są konieczne. Dlatego diagnostyka nieinwazyjna jest tak obiecująca i życzę sobie i wszystkim embriologom, aby w ciągu najbliższych lat mogła całkowicie zastąpić biopsję trofektodermy. Mimo wszystko, na pewno nie stanie się to dziś ani jutro. Potrzeba czasu, aby metoda została udoskonalona, ujednolicona, skuteczna i stosowana na co dzień.